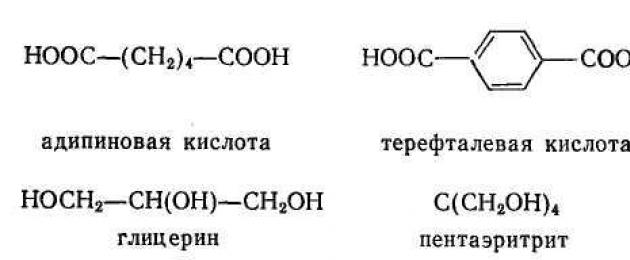Продукты этой отрасли промышленности отличаются большим многообразием строения, свойств и областей применения. Это различные углеводороды, хлор- и фторпроизводные, спирты и фенолы, простые эфиры, альдегиды и кетоны, карбоновые кислоты и их производные (сложные эфиры, ангидриды, нитрилы и др.), амины и нитросоединения, вещества, содержащие серу и фосфор, и т. д. По назначению все они подразделяются на две группы: промежуточные продукты для синтеза других веществ в этой же или других отраслях органической технологии и продукты целевого применения в разных отраслях народного хозяйства.
Промежуточные продукты. Многие вещества, почти не имеющие целевого применения в народном хозяйстве, производят главным образом для того, чтобы на их основе синтезировать другие ценные соединения. Это - промежуточные продукты органического синтеза. Так, основную массу 1,2-дихлорэтана производят для последующей переработки в винилхлорид, окись этилена для получения моноэтиленгликоля.
Роль, масштабы производства и ассортимент промежуточных продуктов очень велики, так как синтез органических соединений протекает через ряд промежуточных стадий.
Мономеры и исходные вещества для полимерных материалов. Их производство занимает одно из самых важных мест в основном органическом и нефтехимическом синтезе, обеспечивающем сырьем промышленность пластических масс, синтетического каучука, синтетических лаков, клеев, пленочных материалов, волокон.
Все синтетические полимеры получают двумя основными способами-полимеризацией и поликонденсацией. Для первой из этих реакций требуются мономеры, т. е. вещества, способные под влиянием тепла, света, облучения или катализаторов соединяться друг с другом без выделения каких-либо низкомолекулярных соединений и давать длинные цепи полимера с теми же элементарными звеньями, как в исходном мономере: полимеризация этилена.
Из мономеров отметим моноолефины (этилен, пропилен, изобутен), диены (бутадиен-1,3 и изопрен, являющийся основой при получении каучука) и стирол.
При поликонденсации исходные вещества должны иметь не менее двух функциональных групп, способных реагировать друг с другом. Так, при образовании полиэфиров взаимодействуют гидрокси- и карбокси-группы:
Исходные вещества для поликонденсационных процессов принадлежат к разнообразным ди- и полифункциональным соединениям. Это - фосген СОС1 2 , дикарбоновые кислоты, их ангидриды и хлорангидриды, а также ряд поликарбоновых кислот и их ангидридов, гликоли и полигликоли, диамин:

При реакциях полимеризации и поликонденсации очень важное значение имеет чистота реагентов. Содержащиеся в них примеси могут ингибировать реакцию или обрывать рост цепи молекулы при полимеризации, нарушать нужное соотношение исходных веществ при поликонденсации, приводя к полимерам со слишком малой молекулярной массой и пониженными техническими показателями. В этом отношении к продуктам основного органического и нефтехимического синтеза предъявляют очень высокие требования, причем чистота мономеров нередко должна соответствовать содержанию основного вещества 99,8- 99,9 % и более (изобутилен полимеризационной чистоты).
Пластификаторы и другие вспомогательные вещества для по лимерных материалов. В производстве синтетических полимеров и изделий из них наряду с мономерами и исходными веществами большую роль играют пластификаторы и другие вспомогательные вещества, которые способствуют процессу синтеза или улучшают технические свойства получаемых полимеров и изделий.
Пластификаторами (или мягчителями) называют вещества, добавляемые к некоторым полимерам в количестве до 30-40 % для улучшения их пластических, эластических свойств. Это необходимо, во-первых, при переработке полимеров прессованием, вальцеванием и другими методами, для чего полимеры должны быть достаточно текучими. Одной из важнейших групп пластификаторов являются высококипящие сложные эфиры, например дибутил- и диоктилфталаты, некоторые эфиры высших спиртов с дикарбоновыми кислотами или высших карбоновых кислот с двухатомными спиртами, алкилароматические углеводороды, низшие полиолефины и др.
Стабилизаторами называют вещества, повышающие стойкость полимеров и резин к окислительному старению. В качестве стабилизаторов применяются алкилфенолы, ароматические диамины.
Синтетические поверхностно-активные и моющие вещества . Поверхностно-активные свойства появляются у органических веществ, содержащих в молекуле гидрофобную группу и наряду с ней гидрофильную (полярную) группировку, способную к сольватации водой. В обычном мыле - натриевой соли стеариновой или пальмитиновой кислоты RCOONa роль этих групп выполняют соответственно длинная углеводородная цепь и карбоксилатная группа.
Ввиду такой особенности строения поверхностно-активное вещество (ПАВ) концентрируется на поверхности раздела фаз, ориентируясь своей гидрофобной группой к масляно-жировому компоненту системы, а гидрофильной - к воде. В результате значительно уменьшается поверхностное натяжение, что способствует хорошему смачиванию материала и переходу загрязнений в воду. Поверхностно-активные вещества обладают также эмульгирующими и диспергирующими свойствами, пенообразующей способностью.
Поверхностно-активные и моющие вещества особенно широко применяют в быту для стирки тканей и изделий из них и чистки различных предметов. В текстильной промышленности их используют для обработки тканей перед крашением, в машиностроении и металлообработке - при резании металлов, для очистки деталей от масел и механических загрязнений, в парфюмерной промышленности - как компоненты туалетного мыла и косметических средств. В химической технологии они служат эмульгаторами при гетерофазных реакциях (в особенности при эмульсионной полимеризации).
Поверхностно-активные и моющие вещества разделяют на ионогенные и неионогенные, отличающиеся наличием или отсутствием групп, способных к диссоциации в водных растворах. Ионогенные вещества в свою очередь бывают анионо- и катионоактивными, в которых поверхностно-активные свойства определяются соответственно анионом или катионом, образующимся при диссоциации.
К анионоактивным веществам относятся наиболее важные промышленные моющие вещества, в том числе мыла - обычное и получаемое из синтетических жирных кислот (активная часть молекулы - группа RCOO~). Такие ПАВ имеют щелочную реакцию и способствуют разрушению тканей, дают с солями магния и кальция нерастворимые соли, что снижает их моющие свойства в жесткой воде, проявляют активность лишь при значительной концентрации в воде. Эти недостатки в значительной степени отсутствуют у современных синтетических анионоактивных веществ, большинство которых представляют собой натриевые соли органических сульфокислот и кислых эфиров серной кислоты. К их числу принадлежат алкиларенсульфонаты RC 6 H4SO 2 ONa, алкилсульфонаты RSO 2 ONa и алкилсульфаты ROSO 2 ONa с алкильными группами С 12 -C 18 .
Катионоактивные моющие вещества имеют сравнительно небольшое практическое значение. Они чаще всего представляют собой соли аминов или четвертичных аммониевых оснований, например соль алкилбензилтриметиламмония + C1-
В последние годы начали все шире использовать неионогенные моющие вещества. Их синтезируют из этиленоксида и различных органических соединений - алкилфенолов, карбоновых кислот, спиртов, аминов и других веществ с активными атомами водорода. Гидрофильные свойства им придает оксиэтильная цепь, например R(OCH 2 CH 2) n OH.
Поскольку поверхностно-активные вещества после их употребления попадают в сточные воды, важным требованием является высокая степень их биоразлагаемости, т. е. способности к окислению в безвредные вещества под влиянием микроорганизмов, находящихся в естественных водоемах. Это налагает определенные ограничения на строение входящего в состав ПАВ углеводородного остатка, который не должен быть разветвленным.
Синтетическое топливо, смазочные масла и добавки к ним. Многие продукты основного органического и нефтехимического синтеза имеют важное значение в автомобильном транспорте, авиации, ракетной технике и других областях. К ним относятся синтетические моторные и ракетные топлива, смазочные масла, присадки, улучшающие свойства топлив и масел, антифризы, препятствующие замерзанию охлаждающих жидкостей, тормозные и гидравлические жидкости.
В качестве высокооктановых компонентов моторных топлив применяют изопарафины, изопропилбензол С 6 Н 5 СН(СН 3)2, трет-бутилметиловый эфир (СН 3)зСОСН 3 и др.
Синтетические смазочные масла принадлежат к нескольким группам органических соединений, из которых важнейшими являются следующие: синтетические углеводороды (низшие полимеры олефинов и алкилированные ароматические углеводороды); сложные эфиры двухосновных карбоновых кислот и высших одноатомных спиртов, а также высших монокарбоновых кислот и многоатомных спиртов.
Применяют различные присадки, повышающие эксплуатационные качества топлив и масел и их стабильность при хранении. Антиокислительные присадки к топливу и смазочным маслам, а также к полимерам (например, алкилированные фенолы) замедляют цепные реакции автоокисления. Другие присадки понижают температуру застывания масел (депрессоры), улучшают их вязкостные свойства (вязкостные присадки), препятствуют коррозии металлов (ингибиторы коррозии) и т. д.
Растворители и экстрагенты . Синтетические растворители должны, кроме того, был дешевыми, легко доступными и мало токсичными. Температура кипения их не должна быть слишком низка во избежание чрезмерных потерь и не должна быть слишком высока, чтобы их можно было регенерировать путем отгонки. В ряде случаев удалось синтезировать растворители с пониженной пожароопасностью и даже совсем негорючие.
В настоящее время растворители и экстрагенты применяют очень широко: для выделения ароматических углеводородов из продуктов переработки нефти, в процессах азеотропной и экстрактивной перегонки, для извлечения жиров и масел из природных веществ. В химической промышленности их часто используют, например, для очистки и перекристаллизации, как абсорбенты газов и паров (ацетилена и летучих веществ, уносимых газами), при синтезе полимеров (особенно в лакокрасочной промышленности). В машиностроении и металлообработке рас творителями обезжиривают и очищают детали. В сельском хозяйстве растворители нужны при употреблении пестицидов.
Синтетические растворители и экстрагенты могут принадлежать к различным группам органических соединений. Это - бензол, хлорпроизводные углеводородов (тетрахлорметан, дихлорметан, три- и тетрахлорэтилен), спирты (этанол, пропанол, бутанолы, пентанолы), целлозольвы, простые эфиры (диэтиловый, диизо-пропиловый и высшие), кетоны (ацетон, метилэтилкетон, изобутилметилкетон), сложные эфиры (этил-, бутил- и пентилаце-тат), а также диметилформамид HCON(CH 3)2, диметилсульф-оксид (CH 3) 2 SO и др.
Пестициды и химические средства защиты растений . Пестицидами (или ядохимикатами) называют вещества, обладающие токсичными свойствами по отношению к тем или иным живым организмам - от бактерий и грибков до растений и вредных животных. Значительная часть пестицидов применяется в сельском хозяйстве в качестве химических средств защиты растений; кроме того, их используют в быту, для борьбы с распространителями болезней и эпидемий, для уничтожения вредителей на складах, в трюмах кораблей, в жилых зданиях и т. д. Применение пестицидов в сельском хозяйстве позволяет избежать многих болезней полевых и садовых культур и значительно уменьшить потери урожая. В связи с этим химические средства защиты растений стали не менее важным фактором в повышении урожайности, чем химические удобрения.
СЫРЬЕ ДЛЯ НЕФТЕХИМИЧЕСКОГО СИНТЕЗА И ЕГО ПОДГОТОВКА Сырье для нефтехимического синтеза
из "Основы технологии нефтехимического синтеза"
Развитие нефтехимической промышленности связано с использованием в качестве сырья низкомолекулярных олефинов - этилена, пропилена, изобутилена и н-бутилена. Позднее химической переработке стали подвергаться амилены, а затем метан, этан, пропан, бутаны и пентан. Большое значение приобретают промышленные синтезы на основе ацетилена, надежным источником для которого является метан.В настоящее время для нефтехимического синтеза широко применяются также и жидкие углеводороды нефти. Из года в год увеличивается потребление бензола, толуола, ксилолов и нафталина для синтеза моющих веществ, синтетических волокон, ядохимикатов и др. Все в больших масштабах используют твердые парафины в процессах окисления с целью получения синтетических жирных кислот и спиртов, а также мягкие (жидкие) парафины. Парафины применяются также для сульфоокис-ления и сульфохлорирования. При крекинге твердых парафинов получают а-олефины, из которых производят вторичные алкилсульфаты - моющие вещества.
Среди нафтеновых углеводородов особое место занимает циклогексан, используемый как полупродукт и как растворитель в производстве синтетического волокна и пластических масс. Применение циклогексана в этих целях стимулировало увеличение его производства.
При разработке газовых месторождений природные газы являются целевым продуктом. Природный газ состоит в основном из метана и некоторого количества других углеводородных газов, а также примеси инертных и редких газов (см. табл. 0.2). Добываются газы и из газоконденсатных месторождений - глубоко залегающих газовых месторождений с высоким давлением в пласте. После снижения давления такие газы выделяют конденсат- жидкие углеводороды, выкипающие до 300 °С и выше, которые также могут быть использованы как химическое сырье. Например, Карадагский конденсат имеет н. к. 57°С, содержит фракции до 100°С-14%, до 150°С -40%, до 200 С -57% и к. к. 340° с. Карадагский газ содержит до 168 г конденсата на 1 Л1 газа, газы Саратовского газоконденсатного месторождения содержат 45 г конденсата на 1 м.
Можно осуществлять химическую переработку и газов коксования, содержащих до 2,5% олефинов. Генераторные газы и газы сланцепереработки можно применять в процессах с использованием водорода либо для синтезов на основе окиси углерода и водорода эти газы содержат до 63% водорода, 15% окиси углерода, 12% метана и незначительное количество (0,5%) олефинов.
Нефтехимический синтез располагает многообразными возможностями химических превращений углеводородов. Химической переработке подвергаются индивидуальные углезодороды или узкие фракции, которые выделяют из природных и попутных газов, газов нефтепереработки, из жидких продуктов термокаталитических процессов переработки нефтяного сырья. Ниже рассматриваются основные превращения индивидуальных углеводородов.
Мета является составной частью попутных, природных и искусственных газов. В настоящее время разработаны и внедрены в промышленность различные методы его химической переработки. Одним из перспективных процессов является окисление метана с образованием формальдегида, метанола и ацетальдегида.
При пиролизе и дегидрировании метана можно получать ацетилен, сажу и водород. При конверсии метана водяным паром или водяным паром и кислородом получают синтез-газ (СО-Ь -ЬНг) -сырье, используемое для дальнейшего органического синтеза, а также в отдельности чистую окись углерода и водород, которые применяют для процессов гидрирования и синтеза аммиака. Аммиак идет на синтез мочевины, представляющей ценный продукт для производства пластмасс и эффективное удобрение.
При хлорировании метана в промышленных масштабах полу, чают хлористый метил, хлористый метилен, хлороформ и четыреххлористый углерод. При нитровании метана образуется нитрометан, используемый в качестве растворителя при изготовлении различных лаков.
Схема основных направлений переработки метана показана на рис. I. I.
При пиролизе этана образуется этилен-исходное сырье для синтеза окиси этилена, этилового спирта, полиэтилена, стирола и других продуктов (рис. I. 2). При окислительном пиролизе образуется ацетилен, при хлорировании получают хлористый этил, применяемый для изготовления тетраэтилсвинца, спиртов, пластмасс, а при нитровании - нитроэтан и нитрометан, широко употребляемые в качестве растворителей.
Пропан. При окислении пропана получают ацетальдегид, формальдегид, уксусную кислоту, ацетон. При пиролизе пропана образуется этилен и пропилен. Наряду с метаном и этаном пропан можно использовать и для получения ацетилена (см. рис. I. 2). При нитровании пропана получается нитрометан, нитроэтан и нитро пропан. Продукты хлорирования пропана пока не имеют промышленного значения.
ТОПЛИВ. При дегидрировании изобутана образуется изобутилен - сырье для получения бутилкаучука, полиизобутилена, полимербензина кроме того, изобутан является широко распространенным алкилирующим агентом.
Этилен. В нефтехимических синтезах в наибольших количествах используется этилен. Из него получают этиловый спирт, окись этилена, полиэтилен, стирол, ди.хлорэтан и другие продукты. Основная масса этилена в ближайшие годы будет перерабатываться в полиэтилен (рис. I. 4).
Пропилен. Пропилен служит сырьем для синтеза полипропилена, изопропилового спирта, изопропилбензола, на основе которого получают фенол и ацетон, глицерина и эпихлоргидрина, тетрамеров пролилена для моющих веществ, метилстирола, окиси пропилена, акролеина, амилового спирта и других продуктов (рис. I. 5). В последнее время приобретает значение промышленный синтез акрилонитрила из пропилена и аммиака. Выработка изопропилбензола возрастает из года в год и будет расти и дальше, так как на его основе получают самый дешевый фенол, потребности в котором очень велики.
Продукты, получаемые на основе пропилена, бключая полипропилен, можно вырабатывать на нефтеперерабатывающих заводах, располагающих большими ресурсами пропилена в виде пропан-пропиленовой фракции.
Бутилены. Бутилены играют весьма важную роль в нефтехимической промышленности в основном они используются для синтеза каучуков. Наиболее массовым сырьем для производства синтетических каучуков являются бутилен-1 и бутилен-2 - промежуточные продукты, образующиеся при производстве бутадиена. Сополимеризацией изопрена и изобутилена получают специальный сорт синтетического каучука - бутил-каучук.
На основе бутиленов бутан-бутиленовой фракции крекинг-газов осуществляют промышленное производство алкилата - высокооктановой добавки к моторному топливу. В промышленном масштабе выпускают низкомолекулярный и высокомолекулярный полиизобутилены, применяемые как загустители для нефтяных смазочных масел и для других целей. Бутилены используют также для промышленного производства вторичных и третичных бутиловых спиртов и других продуктов (рис. I. 6).
Ацетилен. Ацетилен служит исходным сырьем для синтеза большого числа продуктов нефтехимической промышленности. Растущий из года в год спрос на ацетилен вызвал необходимость разработки новых экономичных способов его получения. В настоящее время в промышленности освоен способ производства ацетилена из природного газа - термоокислительным пиролизом метана, т. е. расщеплением метана за счет сжигания части газа с кислородом, подаваемым в процесс.
Введение
Нефтехимический синтез - это получение химических продуктов на основе нефти и углеводородных газов синтетическим путём. Углеводороды нефти и газов природных горючих, газов нефтяных попутных, газов нефтепереработки служат основным сырьём в производстве важнейших массовых синтетических продуктов: пластмасс, каучуков и волокон, азотных удобрений, поверхностно-активных и моющих веществ, пластификаторов; топлив, смазочных масел и присадок к ним, растворителей, экстрагентов и др. Все эти продукты широко применяются в различных отраслях нар. х-ва и в быту, с ними связано развитие MH. новых областей техники (космонавтики, атомной энергетики и др.). В промышленно развитых странах нефтехимический синтез позволил создать крупную и быстро развивающуюся нефтехимическую промышленность. Углеводороды нефти и газов, являясь достойным, более технологичным и дешёвым сырьём, вытесняют остальные виды сырья (угли, сланцы, растительное, животное сырьё и пр.) почти во всех процесс органического синтеза. Нефтехимический синтез базируется на успехах органической химии, катализа, физ. химии, хим. технологии и др. наук и связан с глубоки изучением состава нефтей и свойств их компонентов. В основе процессов переработки углеводородного сырья в целевые продукты лежат многочисленные реакции органической химии: пиролиз, окисление, алкилирование, дегидрирование и гидрирование, галогенирование, полимеризация, нитрование, сульфирование и др. ; важнейшее значение среди них имеют каталитические реакции. В производстве продуктов. Нефтехимический синтез большое место занимает подготовка углеводородного сырья и получение первичных исходных углеводородов: предельных (парафиновых), непредельных (олефиновых, диеновых, ацетилена), ароматических и нафтеновых. Основная их часть превращается в функциональные производные с активными группами, содержащими кислород, азот, хлор, фтор, серу и др. элементы.
Предельные (алкановые) углеводороды занимают важное место по объёму
использования в нефтехимическом синтезе.
Глава. 1. Общие правила техники безопасности при работе в химической лаборатории
1.1. Техника безопасности
1. Работать одному в лаборатории категорически запрещается, так как в ситуации несчастного случая некому будет оказать помощь пострадавшему и ликвидировать последствия аварии.
. Во время работы в лаборатории необходимо соблюдать чистоту, тишину, порядок и правила техники безопасности, так как поспешность и небрежность часто приводят к несчастным случаям с тяжелыми последствиями.
. Каждый работающий должен знать, где находятся в лаборатории средства противопожарной защиты и аптечка, содержащая все необходимое для оказания первой помощи.
. Категорически запрещается в лаборатории курить, принимать пищу, пить воду.
. Нельзя приступать к работе, пока учащиеся не усвоят всей техники ее выполнения.
. Опыты нужно проводить только в чистой химической посуде. После окончания эксперимента посуду сразу же следует мыть.
. В процессе работы необходимо соблюдать чистоту и аккуратность, следить, чтобы вещества не попадали на кожу лица и рук, так как многие вещества вызывают раздражение кожи и слизистых оболочек.
. Никакие вещества в лаборатории нельзя пробовать на вкус. Нюхать вещества можно, лишь осторожно направляя на себя пары или газы легким движением руки, а не наклоняясь к сосуду и не вдыхая полной грудью.
. На любой посуде, где хранятся реактивы, должны быть этикетки с указанием названия веществ.
. Сосуды с веществами или растворами необходимо брать одной рукой за горлышко, а другой снизу поддерживать за дно.
. Категорически запрещается затягивать ртом в пипетки органически вещества и их растворы.
. Во время нагревания жидких и твердых веществ в пробирках и колбах нельзя направлять их отверстия на себя и соседей. Нельзя также заглядывать сверху в открыто нагреваемые сосуды во избежание возможного поражения при выбросе горячей массы.
. После окончания работы необходимо выключить газ, воду, электроэнергию.
. Категорически запрещается выливать в раковины концентрированные растворы кислот и щелочей, а также различные органические растворители, сильно пахнущие и огнеопасные вещества. Все эти отходы нужно сливать в специальные бутыли.
. В каждой лаборатории обязательно должны быть защитные маски, очки.
. В каждом помещении лаборатории необходимо иметь средства противопожарной защиты: ящик с просеянным песком и совком для него, противопожарное одеяло (асбестовое или толстое войлочное), заряженные огнетушители.
. В доступном месте в классе-лаборатории должен быть «Уголок техники безопасности», где необходимо разместить конкретные инструкции по методам безопасности работы и правила поведения в химическом кабинете.
. При работе в лаборатории необходимо применять индивидуальные средства защиты, а также соблюдать правила личной гигиены.
1.2 Общие положения работы в лаборатории
нефтехимического синтеза
В составе лаборатории работают научные сотрудники, инженеры и лаборанты, приглашенных из ведущих научных центров. Основным направлением работ лаборатории является создание технологий для производства продуктов основного органического синтеза. Также проводятся разработки гомогенных и гетерогенных каталитических систем для новых и существующих процессов нефтехимии.
Научно-исследовательские и опытно-конструкторские работы лаборатории НХС посвящены:
новым катализаторам полимеризации для получения высокомолекулярных соединений;
химической модификации промышленных полимеров;
разработке новых технологий получения существующих мономеров;
получению новых перспективных мономеров;
поиску методов утилизации и переработки отходов химических предприятий.
Для выполнения поставленных задач лаборатория оснащена всем необходимым оборудованием. Для работы под давлением применяется линейка современных реакторов с компьютерным управлением. С металлорганическими соединениями и другими высокочувствительными к влаге и кислороду веществами работы ведутся в перчаточных боксах. Химическая микроволновая система MARS позволяет проводить реакции при температуре до 3000С и давлении до 100 атм. Лаборатория оснащена вспомогательным общелабораторным оборудованием ведущих мировых производителей.
Организация работ в лабораториях
Лаборатории по процессам и аппаратам химической и пищевой технологии оснащены полупромышленными (пилотными) установками, на которых студенты экспериментально изучают процессы. Обработка полученных на установках опытных данных математическими методами позволяет анализировать влияние параметров на процесс.
В лабораториях проводятся лабораторные работы по следующим дисциплинам: «Процессы и аппараты химической технологии», «Процессы и аппараты пищевых производств», «Общая химическая технология», «Моделирование и расчет на ЭВМ химико-технологических процессов» и др.
Обработка опытных данных и метод планирования эксперимента
Основная цель планирования эксперимента - достижение максимальной точности измерений при минимальном количестве проведенных опытов и сохранении статистической достоверности результатов. Планирование эксперимента применяется при поиске оптимальных условий, построении интерполяционных формул, выборе значимых факторов, оценке и уточнении констант теоретических моделей и др. Планирование эксперимента (активный эксперимент) в химии, раздел материальной статистики, изучающий методы организации совокупности опытов с различными условиями для получения наиболее достоверной информации о свойствах исследуемого объекта при наличии неконтролируемых случайных возмущений. Величины, определяющие условия данного опыта, обычно называют факторами (например, температура, концентрация), их совокупность - факторным пространством. Набор значений факторов характеризует некоторую точку факторного пространства, а совокупность всех опытов составляет так называемый факторный эксперимент. Расположение точек в факторном пространстве определяет план эксперимента, который задает число и условия проведения опытов с регистрацией их результатов.
Начало планированию эксперимента положили труды P. Фишера (1935). Он показал, что рациональное планирование эксперимента дает не менее существенный выигрыш в точности оценок, чем оптимальная обработка результатов измерений. Планирование эксперимента используют для изучения и математического описания процессов и явлений путем построения математических моделей (в форме так называемых уравнений регрессии) - соотношений, связывающих с помощью ряда параметров значения факторов и результаты эксперимента, наз. откликами. Основное требование, предъявляемое к планам факторного эксперимента, в отличие от пассивного эксперимента - минимизация числа опытов, при которой получают достоверные оценки вычисляемых параметров при соблюдении приемлемой точности математических моделей в заданной области факторного пространства. В этом случае задача обработки результатов факторного эксперимента заключается в определении численных значений указанных параметров.
Экстремальные задачи имеют целью определить наилучшее значение целевой функции, в качестве которой принимают значение интересующей исследователя характеристики процесса. Такие задачи могут быть решены по крайней мере двумя способами: с построением и без построения математической модели. На основе выбранного плана строят модель, отвечающую рассматриваемому отклику, и, используя ее, с помощью известных методов поиска экстремума находят значения факторов, при которых целевая функция, определенная по модели, будет экстремальной. Если найденные значения факторов, соответствующие экстремальной точке, лежат на границе примененного плана, область планирования либо смещается, либо расширяется и строится новая модель, после чего поиск экстремума повторяется. Задача считается решенной, если вычисленные координаты точки экстремума находятся внутри области, характеризуемой использованным планом.
На практике такой подход часто реализуют методом так называемого крутого восхождения (метод Бокса-Уилсона). Выбирают начальную точку; по его результатам рассчитывают параметры математической модели 1-го порядка. Если модель адекватна, с ее помощью определяют направление изменения факторов, соответствующее движению к экстремальному значению целевой функции в направлении градиента или антиградиента (соответственно при поиске максимума или минимума). Движение в выбранном направлении осуществляют с помощью последовательно выполняемых опытов и производят до тех пор, пока отклик изменяется желаемым образом. Изложенную процедуру повторяют до построения адекватной модели на каждом этапе. Неадекватность модели, полученной на очередном этапе, свидетельствует о том, что, возможно, достигнута область экстремума, в которой линейную модель уже нельзя использовать. Для уточнения положения экстремума в этой области можно применять модель 2-го порядка, построенную посредством соответствующих планов.
Непосредственный эксперимент на объекте (без построения модели). Стратегия проведения опытов определяется выбранным методом оптимизации. При этом значение целевой функции вычисляют не по модели, а находят непосредственно из опыта, выполненного в соответствующих условиях. Наиболее часто для поиска наилучшего значения целевой функции используют последовательный симплексный метод, метод Гаусса-Зейделя и т. п. Изучение кинетики и механизмов процессов связано, как правило, с разработкой так называемых детерминирующих моделей, отражающих физико-химическую сущность исследуемых явлений и содержащих описания механизмов (кинетики) протекающих в них элементарных процессов.
Среди задач, решаемых методами планирования эксперимента, можно выделить:
) определение (уточнение) параметров моделей;
) т. наз. дискриминацию, т. е. отбрасывание проверяемых механизмов элементарных процессов.
Для уточнения параметров детерминирующих моделей необходимо выбрать такой план эксперимента, который обеспечит наилучшие оценки определяемых величин. При уточнении параметров планирование эксперимента сталкиваются с рядом трудностей.
К основным из них можно отнести:
) необходимость иметь отдельный план для каждого класса моделей, то есть в каждой конкретной ситуации исследователь должен вычислить оптимальное расположение точек в факторном пространстве для постановки уточняющих экспериментов;
) необходимость расчета параметров детерминирующих моделей с использованием методов оптимизации; это обусловлено обычно нелинейностью данных моделей относительно определяемых параметров.
Задача дискриминации заключается в выборе такой модели среди нескольких конкурирующих, которая наиболее правильно отражает механизм процесса и обладает наилучшей предсказательной способностью. Эта задача реализуется сопоставлением результатов оценки соответствия модели опытным данным при использовании различных описаний одного и того же процесса или явления. Самый простой метод дискриминации состоит в вычислении параметров каждой предложенной модели по экспериментальным данным и последующем сравнении остаточных дисперсий. В качестве выбранной модели принимают модель с минимальной остаточной дисперсией. Если не удается выбрать механизм, не противоречащий опытным данным, то либо расширяют исследуемую область, либо смещают расположение точек в факторном пространстве и операцию повторяют. Достоинство такого подхода заключается в том, что исследователь одновременно решает обе задачи - вычисление параметров и дискриминацию моделей. К недостаткам можно отнести то, что при этом часто требуются большие затраты времени на эксперименты и расчет параметров моделей.
Практические работы по нефтехимическому синтезу
Практические работы базируется на успехах органической химии, катализа, физической химии, химической технологии и др. наук и связан с глубоким изучением состава нефтей и свойств их компонентов. В основе процессов переработки углеводородного сырья в целевые продукты лежат многочисленные реакции органической химии: пиролиз, окисление, алкилирование, дегидрирование и гидрирование, галогенирование, полимеризация, нитрование, сульфирование и др.; важнейшее значение среди них имеют каталитические реакции. В производстве продуктов из нефтехимического синтеза большое место занимает подготовка углеводородного сырья и получение первичных исходных углеводородов: предельных (парафиновых), непредельных (олефиновых, диеновых), ароматических и нафтеновых. Основная их часть превращается в функциональные производные с активными группами, содержащими кислород, серу и др. элементы. Большое значение имеют процессы конверсии парафиновых углеводородов в синтез-газ (смесь окиси углерода с водородом, см. Конверсия газов). Сырьём могут быть газы природные, попутные, нефтепереработки и любые нефтяные фракции. Аммиак служит исходным продуктом для производства удобрений (аммиачной селитры, мочевины), синильной кислоты и др. Двухступенчатой конверсией метана производят также концентрированную углерода окись, используемую для многих процессов. Из окиси углерода и водорода вырабатывается метанол - сырьё, из которого получают формальдегид, важнейший продукт для производства пластмасс, лаков, клеев и пр. материалов.
В промышленных масштабах вырабатывают галогенопроизводные парафинов. Из метана получают метилхлорид, хлороформ, четырёххлористый углерод и др. продукты. Метиленхлорид и четырёххлористый углерод являются хорошими растворителями. Хлороформ используют для синтеза тетрахлорэтилена, хлорфторпроизводных, ценного мономера тетрафторэтилена и прочих. Хлорированием этана производят гексахлорэтан и др. хлорпроизводные. Продукт хлорирования твёрдых парафинов хлорпарафин-40 используется в качестве пластификатора, хлорпарафин-70 - для пропитки бумаги и тканей повышенной огнестойкости. Продукты полного фторирования узких фракций керосина и газойля являются ценными смазочными веществами и гидравлическими жидкостями, обладающими высокой термической и химической стойкостью. Они могут работать продолжительное время при 250-300С в очень агрессивных средах. Фреоны - хлорфторпроизводные метана и этана - применяются в качестве хладоагентов в холодильных машинах. Нитрованием пропана и парафинов, кипящих выше 160-180С, азотной кислотой вырабатывают смесь нитропарафинов. Они используются как растворители и промежуточные продукты синтеза нитроспиртов, аминоспиртов, взрывчатых веществ. Нафтены. Из этих углеводородов только циклогексан приобрёл большое значение. В небольших количествах циклогексан выделяется чёткой ректификацией бензиновых фракций нефти (содержащих 1-7% циклогексана и 1-5% метилциклопентана). Метилциклопентан превращают в циклогексан изомеризацией с хлористым алюминием. Промышленная потребность в циклогексане удовлетворяется в основном получением его гидрированием бензола в присутствии катализатора.
Окислением циклогексана кислородом воздуха производят циклогексанон и адипиновую кислоту, которые используются в производстве полиамидных синтетических волокон (капрона и нейлона). Адипиновая кислота и др. дикарбоновые кислоты, получаемые при окислении циклогексана, используются для синтеза эфиров, применяемых в качестве смазочных масел и пластификаторов. Циклогексанон находит применение как растворитель, а также как заменитель камфары. Большое внимание уделяется развитию микробиологического синтеза на базе нефтяного сырья. Из парафиновых углеводородов получают белково-витаминные концентраты для питания животных.
Глава. 2. Виды процессов
1 Процессы гидрирования и дегидрирования
В органическом синтезе в реакциях гидрирования (присоединения H2)
участвуют любые молекулы, имеющие ненасыщенные. Синтезы Фишера-Тропша из СО и
Н2, синтез метанола из СО, СО2 и Н2 также относят к реакциям гидрирования,
однако в синтезе углеводородов по Фишеру-Тропшу, кроме присоединения Н2,
происходит и деструктивное гидрирование с разрывом С-О связи. К деструктивному
гидрированию относится и гидрогенолиз связи С-С - процессы гидрокрекинга,
например,
и гидрогенолиз связи С-S (процессы гидрообессеривания нефтяных фракций)
Обратная гидрированию реакция - процесс дегидрирования - занимает важное место в промышленном органическом синтезе и в процессах нефтепереработки. Дегидрируют алканы и алкилбензолы (синтезы бутадиена, изопрена, стирола), нафтены (бензол из циклогексана), спирты (синтезы формальдегида, ацетона, изовалерианового альдегида, циклогексанона). В качестве катализаторов гидрирования используют металлы и их соединения:
Металлические катализаторы - Pt, Pd, Ni, Co, Rh, Ru, Cu - в форме массивных металлов, сплавов, нанесенных катализаторов (М/носитель) и скелетных металлов (никель Ренея, медь Ренея), которые получают выщелачиванием Al из сплавов Al-Ni, Al-Cu и др.
Сульфиды металлов - NiS, CoS, Mo2S3, W2S3.
Оксиды металлов применяют для процессов дегидрирования, поскольку при высоких температурах (> 200оС) металлы слишком активны и ведут деструктивные процессы. Катализаторами дегидрирования являются следующие оксиды: ZnO, Cr2O3, Mo2O3, W2O3, MgO. При высоких температурах (> 450оС) дегидрирование спиртов наблюдается и на -Al2O3.
Важнейшая стадия процессов гидрирования - активация молекулы водорода. В
случае комплексов металлов в растворах механизм активации водорода сейчас уже
ясен:
Превращение первичного комплекса зависит от природы металла, его степени
окисления и лигандов в координационной сфере. Возможны гомолиз и гетеролиз:
Участия недиссоциированной молекулы H2 в процессах гомогенного
гидрирования пока не установлено. Гидрогенолиз связи М-С, например, в процессе
гидроформилирования олефинов
также рассматривают как результат гомолитического расщепления молекулы Н2
на атоме Со. На поверхности металлов имеет место гомолитическое расщепление Н2 с
образованием поверхностных атомов водорода и атомов водорода, растворенных в
решетке металла. При наличии полярного растворителя (S) процесс адсорбции Н2 на
металлах может проходить гетеролитически и даже сопровождаться полной
ионизацией с переносом 2ē на металл.
В этом случае молекулу гидрируемого соединения восстанавливают электроны,
связанные с металлом. При построении кинетических моделей процессов
гидрирования на металлах используют представления об однородной поверхности, о
равномерно-неоднородной поверхности (модели Лэнгмюра-Хиншельвуда) и о
неоднородной поверхности. Например, при гидрировании этилена в рамках гипотезы
о взаимодействии адсорбированных на поверхности Niтв этилена и водорода:
![]() (6);
(6);
На однородной поверхности:
 (7);
(7);
На равномерно-неоднородной поверхности:
 (8);
(8);
Процесс риформинга направлен на изомеризацию и ароматизацию н-парафинов без изменения молекулярной массы (числа атомов углерода) в исходных молекулах в процессе превращений. Основные реакции:
а) ароматизация
б) дегидроциклизация парафинов
 (10);
(10);
в) скелетная изомеризация
г) дегидрирование
Риформинг используют для получения из нафты (температура кипения 80 - 160оС) высокооктановых бензинов и ароматических соединений, которые экстрагируют из бензинов и используют в качестве сырья для гидрокрекинга или для органического синтеза. Процесс проводят в интервале 380 - 520оС при давлении 10 - 40 атм на гетерогенных бифункциональных катализаторах - металлических и кислотных - Pt на промотированном Cl- или F- оксиде алюминия (или алюмосиликате). В последнее время используют Pt-Re/Al2O3 или полиметаллические катализаторы на Al2O3. Основной проблемой в процессе риформинга является процесс дезактивации и закоксовывания катализатора (см. приложение 1).
На ионах, расположенных в прямоугольнике, могут находиться делокализованные электроны. Появились уже примеры гидрогенолиза связей C-S с участием комплексов переходных металлов. Исследования таких систем позволят установить механизм процесса и природу возможных интермедиатов.
Процесс алкилирования широко применяется в нефтехимической промышленности для получения высокооктановых компонентов бензина. Исходным сырьем для процесса является изобутан и бутан-бутиленовая или пропан-пропиленовая фракция, полученная в процессе каталитического крекинга.
Технологическая установка для сернокислотного алкилирования включает несколько секций. Первоначально материалы для алкилирования должны быть охлаждены до температуры 4 - 50С (400F) и переведены в жидкую фазу.
Этот процесс осуществляется в холодильном аппарате при повышенном давлении (3 - 15 атм). Далее вещество попадает в реакторный блок состоящий из нескольких отдельных реакторов. Кроме того, в реакторе к сжиженным продуктам реакции добавляется серная кислота в качестве катализатора процесса.
Количество секций и конструкция реактора должно обеспечивать длительное нахождение и периодическое перемешивание молекул в реакторной зоне для осуществления реакции алкилирования. Через 15 - 20 минут продукция реактора подается в узел отделения кислоты. Кислотный отстойник представляет собой сосуд без перемешивания. В нем происходит отделение кислоты от углеводородов. Разница в плотности между веществами позволяет углеводородам подняться вверх в сосуде. Кислота, в свою очередь, опускается на дно и возвращается в реактор. А углеводороды поступают на щелочную промывку в специальный сосуд. В узле щелочной промывки продукты алкилирования обрабатываются едким натром, который нейтрализует кислоту. После промывки углеводородная смесь поступает последовательно в три стандартные ректификационные колонны - дебутанизатор, деизобутанизатор, депропанизатор. В них осуществляется разделение смеси на алкилат и насыщенные газообразные углеводороды. При этом изобутан направляется в холодильный агрегат для повторного прохождения процесса.
Оборудование для процесса алкилирования:
Холодильная установка ГОСТ 11875-88
Настоящий стандарт распространяется на холодильники с вращающимися барабанами общего назначения, применяемые в химической и других отраслях промышленности для охлаждения взрывобезопасных сыпучих материалов. Стандарт не распространяется на барабанные холодильники для цементной и керамзитовой промышленности
Реакторы для алкилирования ГОСТ 20680-2002
Настоящий стандарт распространяется на стальные аппараты с механическими перемешивающими устройствами номинальным объемом от 0,01 до 100 м куб. , предназначенные для проведения различных технологических процессов в жидких средах плотностью до 2000 кг/м куб. и динамической вязкостью не более 200 Па. с при рабочей температуре от минус 40 до плюс 350 град. С и рабочем избыточном давлении не более 6,3 МПа, на гуммированные аппараты в части изготовления металлических конструкций, а также на аппараты, работающие при отсутствии давления и под вакуумом с остаточным давлением не ниже 665 Па. Стандарт не распространяется на аппараты с эмалевым покрытием и аппараты, изготовленные из чугуна и неметаллических материалов, а также обогреваемые топочными газами или открытым пламенем.
Узел отделения кислоты и узел щелочной промывки ГОСТ 26159-84
Настоящий стандарт распространяется на чугунные сосуды и аппараты, применяемые в химической, нефтеперерабатывающей и смежных отраслях промышленности. Устанавливает общие требования к нормам и методам расчета на прочность конструктивных элементов сосудов и аппаратов, работающих при статических нагрузках
Ректификационные колонны ГОСТ 21944-76
Настоящий стандарт распространяется на колонные аппараты с внутренним
диаметром от 400 до 10000 мм, изготовляемые из листовой стали.
3 Процессы окисления
В процессе окислительно-восстановительной реакции восстановитель отдаёт электроны, то есть окисляется; окислитель присоединяет электроны, то есть восстанавливается.
Причём любая окислительно-восстановительная реакция представляет собой единство двух противоположных превращений - окисления и восстановления, происходящих одновременно и без отрыва одного от другого.
Окисление - процесс отдачи электронов, с увеличением степени окисления.
При окисле́нии вещества в результате отдачи электронов увеличивается его степень окисления. Атомы окисляемого вещества называются донорами электронов, а атомы окислителя - акцепторами электронов. В некоторых случаях при окислении молекула исходного вещества может стать нестабильной и распасться на более стабильные и более мелкие составные части (см. Свободные радикалы). При этом некоторые из атомов получившихся молекул имеют более высокую степень окисления, чем те же атомы в исходной молекуле. Окислитель, принимая электроны, приобретает восстановительные свойства, превращаясь в сопряжённый восстановитель: окислитель + e− ↔ сопряжённый восстановитель.
Восстановлением называется процесс присоединения электронов атомом вещества, при этом его степень окисления понижается. При восстановлении атомы или ионы присоединяют электроны. При этом происходит понижение степени окисления элемента.
В любой окислительно-восстановительной реакции принимают участие две
сопряжённые окислительно-восстановительные пары, между которыми имеет место
конкуренция за электроны, в результате чего протекают две полуреакции: одна
связана с присоединением электронов, т. е. восстановлением, а другая - с
отдачей электронов, т. е. окислением. В окислительно-восстановительных реакциях
электроны от одних атомов, молекул или ионов переходят к другим. Процесс отдачи
электронов - окисление. При окислении степень окисления повышается. Процесс присоединения
электронов - восстановление. При восстановлении степень окисления понижается.
Атомы или ионы, которые в данной реакции присоединяют электроны являются
окислителями, а которые отдают электроны восстановителями.
4 Процессы этерификации, гидролиза, гидратации, дегидратации
Реакциями гидролиза называют процессы замещения или двойного обмена, протекающие под действием воды или щелочей. Их можно классифицировать на реакции гидролиза, идущие с расщеплением связей С-Сl, C-O, C-N и др. В отличие от гидролиза, реакции гидратации сводятся к присоединению воды по ненасыщенным С-С-связям, по тройной СN связи нитрилов и т. д. Некоторые реакции гидратации равновесны; обратный процесс расщепления воды называют дегидратацией, которая может быть не только внутри-, но и межмолекулярной. Процесс этерификации - реакции взаимодействия спиртов с органическими кислотами, их ангидридами или хлорангидридами с образованием сложных эфиров. Процесс амидирования - реакции взаимодействия аммиака, первичных или вторичных аминов с карбоновыми кислотами получают амиды кислот. Эти реакции обратимы и во многом сходны с реакциями этерификации, но отличаются от последних тем, что равновесие сильно смещено вправо.
Условия получения глицерина из не пищевого сырья:
гипохлорирование аллилхлорида в дихлоргидрин с последующим его омылением в эпихлоргидрин и щелочным гидролизом;
гидролиз аллилхлорида в аллиловый спирт с последующим его эпоксидированием пероксидом водорода в глицидный спирт и гидролизом с образованием глицерина;
изомеризация пропиленоксида в аллиловый спирт и последующей обработкой как во втором методе.
Спирты из олефинов можно получать прямой гидратацией или косвенно - через
несколько последовательных реакций. Прямая гидратация олефинов приводит к
образованию вторичных или третичных спиртов (кроме этилена, из которого
получается этиловый спирт). Из косвенных методов получения спиртов наиболее
известен метод, основанный на присоединении серной кислоты к олефинам. Вначале
образуются моно- или диэфиры серной кислоты, которые затем гидролизуют в
соответствующие спирты. При изучении способов получения этилового спирта
обратите внимание на факторы, определяющие выбор способа гидратации этилена.
Кроме того, известны два технологических способа прямой гидратации этилена,
различающиеся подачей пара и методом подогрева парогазовой смеси. Для получения
изопропилового спирта в промышленности применяют метод прямой гидратации
пропилена. Способы прямой гидратации пропилена более разнообразны, чем для
этилена, в чем сходство и различие этих методов. Чем объясняется повышенное
внимание к безопасности производства спиртов. При изучении производства
этилацетата обратите внимание на суммарный выход эфира, который составляет 95%
от теоретического, чем это можно объяснить? Процессы амидирования имеют большое
значение для промышленности основного органического и нефтехимического синтеза,
так как дают возможность получать весьма ценные продукты и полупродукты для
дальнейших синтезов. К числу наиболее важных следует отнести: производства
диметилформамида, диметилацетамида, этаноламидов, пластификаторов, гербицидов,
маномеров для синтетического волокна.
5 Процессы присоединения и конденсации по карбонильной группе
Карбонильные соединения - это соединения, содержащие в своем составе одну или несколько карбонильных групп (C=O). К ним относятся СО, СО2, карбонаты, мочевина и многие другие. Однако в органической химии под карбонильными соединениями понимают лишь альдегиды и кетоны, и в меньшей степени карбоновые кислоты и их производные. В альдегидах карбонильная группа связана с одним углеводородным радикалом и одним атомом водорода, а в кетонах оксо-группа связана с двумя углеводородными радикалами.
Карбонильный углерод, находясь в состоянии sp2-гибридизации, образует с кислородным атомом двойную связь. У кислорода в оксосоединениях имеются две несвязывающие пары электронов. Кислород обладает более высокой электроотрицательностью, чем углерод, и электроны у- и, особенно, р-связи углерода и кислорода сильно смещены к атому кислорода. Другими словами, карбонильная группа обладает высокой полярностью. Химическим следствием полярности карбонильной группы являются разнообразные реакции присоединения различных полярных реагентов по карбонильной группе.
Неподеленные пары электронов карбонильного кислорода придают карбонильной группе свойства слабого основания по Льюису, что играет важную роль в интерпретации химических свойств альдегидов и кетонов.
Присоединение металлоорганических соединений:
Металлоорганические соединения присоединяются к карбонильным соединениям с образованием алкоксидов магния или лития, которые легко гидролизуются до спиртов. В случае присоединения реактива Гриньяра к формальдегиду получают первичные спирты, та же самая реакция с другими альдегидами и кетонами приводит к образованию соответственно вторичных и третичных спиртов. Получение вторичных и третичных спиртов из магнийорганических соединений и альдегидов или кетонов часто осложняется побочными процессами. Побочные реакции можно полностью устранить, если для присоединения к карбонильной группе использовать литийорганические соединения. В этом случае удается даже осуществить синтез третичных спиртов, содержащих одновременно три третичные алкильные группы при карбонильном атоме углерода:
Окисление карбонильных соединений:
Альдегиды легко окисляются до карбоновых кислот не только при действии таких реагентов, как перманганат или бихромат, но даже при действии таких слабых окислителей, как ион серебра. Поэтому для идентификации альдегидов применяют реакцию "серебряного зеркала": альдегид реагирует с реактивом Толленса (раствор аммиаката серебра) с выпадением в осадок металлического серебра в виде зеркального покрытия. Окисление кетонов протекает в более жестких условиях, с применением сильных окислителей в кислой или щелочной среде, так как реакция сопровождается разрывом углерод-углеродной связи. Многие кетоны расщепляются с любой стороны карбонильной группы, приводя к образованию смеси кислот.
Восстановление карбонильных соединений:
Альдегиды восстанавливаются в первичные спирты, а кетоны - во вторичные либо в результате каталитического гидрирования, либо путем использования комплексных гидридов: боргидрид натрия и алюмогидрид лития. Боргидрид натрия, в отличии от литийалюмогидрида, обеспечивает избирательное восстановление карбонильной группы альдегидов и кетонов в присутствии других функциональных групп (сложноэфирной, нитрильной, амидной) и двойных С-С связей, которые этот реагент не затрагивает.
Восстановлением кетонов до метиленовой группы амальгамированным цинком в соляной кислоте (восстановление по Клемменсену) получают алкилбензолы с первичной алкильной группой
б-Галогенирование карбонильных соединений:
Альдегиды и кетоны способны реагировать с галогенами с замещением атомов водорода при б-углеродном атоме.
В щелочной среде реакцию трудно остановить на стадии моногалогенирования,
т. к. моногалогенпроизводное в этих условиях быстрее подвергается последующему
галогенированию, чем исходный альдегид или кетон. Поэтому в указанных условиях
все б-водородные атомы замещаются на галоген. Моногалогенкарбонильные
соединения получают в присутствии кислот
6 Процессы сульфирования и сульфатирования
Сульфирование (сульфонирование), введение сульфо-группы SO2OH в молекулу орг. соединения; в широком смысле сульфирование-введение группы SO2X (X = ОН, ONa, OAlk, OAr, Hal, NAlk2 и т. п.). О введении группы SO3H с образованием связей О-S (О-сульфирование, сульфатирование, сульфоэтерификация).
Процесс, обратный сульфированию (удаление группы SO2X из молекулы орг. соединения), наз. десульфированием (десульфонированием). Сульфирование осуществляют прямым путем с использованием сульфирующих агентов либо косвенным путем, например введением сульфогруппы в составе сульфоалкильных фрагментов (СН2)nSО2Х. Сульфирующие агенты: H2SO4, SO3 и его комплексы с орг. соединениями (эфирами, третичными аминами и фосфинами. амидами карбоновых кислот, три-алкилфосфатами и др.), олеум. SOCl2, галогенсульфо-нрвые и сульфаминовые кислоты, диалкилсульфаты, ацил-сульфаты.
Сульфирование ароматич. углеводородов протекает по механизму электроф. Замещения (см. приложение 2).
Реакцию осуществляют как в паровой, так и в жидкой фазе (растворители: SO2, СС14, хладоны и т. п.). При сульфирование серной кислотой для смещения равновесия вправо применяют избыток кислоты или связывают воду добавлением олеума, азеотропной отгонкой и т. п.
Соединения с электронодонорными заместителями более реакционноспособны и сульфируются преим. в орто- и пара-положения; соединения с электроноакцепторными заместителями-в мета-положение. В большинстве случаев при сульфирование замещенных бензолов образуются смеси изомеров, соотношение которых зависит от природы заместителя, сульфирующего реагента и условий реакций (концентрации реагентов, температуры, растворителя, наличия катализаторов и т. д.). Путем подбора оптим. условий возможно селективное сульфирование. Так, сульфирование толуола серной кислотой при 20 °С приводит к равным количествам о- и n-толуолсульфокислот, а при, использовании SO3 в тех же условиях - исключительно к n-изомеру; при сульфирование фенола на холоду преим. образуется о-фенолсульфокислота, тогда как при 100°С-n-фенолсульфокислота. Как правило, подобные различия обусловлены превращением одних изомеров в другие, термодинамически более стабильные, благодаря изомеризации или обратимости сульфирования. Например, нафталин при температурах ниже 100°С первоначально образует α-нафталинсульфокислоту, которая во времени превращ. в β-изомер в результате последовательного десульфирования-ресульфирования. сульфирование при 160°С приводит исключительно к β-нафталинсульфокислоте (см. Нафталинсульфокислоты).
Для сульфирования гетероциклических соединений (фуран, пиррол. тиофен. индол и др.) используют комплексы SO3 с диоксаном или пиридином. Эти же реагенты применяют для сульфирования алифатич. соед., содержащих сильные электроноакцепторные группы; при этом образуются, как правило, a-сульфопроизводные (см. приложение 3).
К косвенным методам сульфирование относят сульфометилирование, сульфоэтилирование и т. д. (см. приложение 4).
Сульфирование используют при получении ПАВ, ионообменных мембран и смол, биологически активных веществ, красителей и др.
Заключение
За тот период, пока я проходил практику я ознакомился с оборудованием связанное с нефтехимическим синтезом, и увидел как правильно работать с ним. Меня ознакомили с инструктажем по технике безопасности, показали рабочие место и как за ним работать.
Преподаватель показал, каким образом нужно проводить работы по нефтехимическому синтезу.
Были проведены процессы гидрирования, дегидрирования, алкилирования. Использованы знания для проведения этерификации гидролиза, гидратации, дегидратации, присоединения и конденсация по карбонильной группе, сульфирования и сульфатирования.
этерификация гидролиз дегидратация карбонильный
Список литературы
1. Большой энциклопедический словарь. Химия. М. , 2001.
2. Грушевицкая T. T. , Садохин А. П. Концепции современного естествознания.
. Концепции современного естествознания. Под. ред. В. Н. Лавриненко, В. П. Ратникова. М. , 1997.
. Кузнецов В. И. Общая химия. Тенденции развития. М. , 1989.
. Кузнецов В. И. , Идлис ГМ. , Гутина В. Н. Естествознание. М. , 1996.
. Молин Ю. Н. О роли физики в химических исследования. Методологические и философские проблемы химии. Новосибирск, 1981.
. Химия//Химический энциклопедический словарь. М. , 1983.
. Пилипенко А. Т. , Пятницкий И. В. Аналитическая химия. - М. : химия, 1990.
. В. П. Васильев Аналитическая химия - М. : Дрофа 2004 г.
. Основы аналитической химии / Под ред. академика Ю. А. Золотова. - М. : Высшая школа, 2002. Кн. 1, 2. 15. Агафошин Н. П. Периодический закон и периодическая система элементов Д. И. Менделеева Дмитрия Ивановича. М. : Просвещение, 1973.
. Евдокиомв Ю. , кандидат химич. наук. К истории периодического закона. Наука и жизнь, № 5 (2009).
. Макареня А. А. , Рысев Ю. В. Д. И. Менделеев Дмитрий Иванович. - М. : Просвещение, 1983.
. Макареня А. А. , Трифонов Д. Н. Периодический закон Д. И. Дмитрия Ивановича Менделеева. - М. : Просвещение, 1969.
Приложение

1. (Дезактивация и закоксовование катализатора).
2. (Сульфалирование ароматических у-в).

3. (Сульфалирование гетероциклических
соеденений).

4. (Сульфометилирование, сульфоэтилирование).
Органический синтез
Промышленность органического синтеза с каждым годом увеличивает выпуск и ассортимент химических продуктов. Среди них можно указать разнообразные мономеры и на их основе синтетические смолы, каучуки, волокна, пластмассы, клеи, красители и большое количество различных лакокрасочных и смазочных материалов, растворителей, поверхностно-активных веществ, ядохимикатов, флотореагентов, антифризов и антидетонаторов, взрывчатых и лекарственных препаратов, фотореактивов, душистых соединений и т. д.
СЫРЬЕ ОРГАНИЧЕСКОГО СИНТЕЗА
В настоящее время почти весь органический синтез базируется на ископаемом органическом сырье: нефти и природных газах, каменном угле, сланцах. В процессах физико-химических превращений этих веществ (риформинг, конверсия, крекинг, пиролиз, коксование, перегонка и ректификация, абсорбционно-десорбционные методы) получают пять групп исходных веществ, используемых для синтеза многих тысяч других соединений (рис.1):
1) парафиновые углеводороды (от СН 4 до смесей C 15 -C 40);
2) олефины (главным образом С 2 Н 4 , С 3 Н 6 , C 4 H 8);
3) ацетилен;
4) оксид углерода и синтез-газ;
5) ароматические соединения (бензол, толуол, нафталин и др.).
Кроме того, в органической технологии в больших количествах
используют и неорганические соединения: кислоты, щелочи, соду, хлор и т. п., без которых невозможно осуществление многих процессов.
| |
В своем развитии промышленность органического синтеза разделилась на ряд специфичных отраслей, среди которых важное место занимает промышленность основного органического и нефтехимического синтеза. Подобно основной неорганической химии и технологии, термин «основной» органический синтез охватывает производство многотоннажных органических веществ, служащих базой для всей остальной органической технологии.
Главным объектом основного органического синтеза является первичная переработка пяти видов исходных веществ в другие продукты (различные углеводороды, хлорпроизводные, спирты и эфиры, альдегиды и кетоны, карбоновые кислоты и их производные, фенолы, нитросоединения, сероорганические соединения, т. е. вещества, на которых основано получение всех других органических продуктов). По практическому назначению продукты основного органического синтеза подразделяют на промежуточные продукты (полупродукты) для синтеза других веществ и продукты целевого назначения.
Связь исходного сырья с готовым продуктом можно представить схемой:
Исходное сырье ® Полупродукты ® ... ® Готовый продукт
Рассмотрим это на следующем примере. Продукт нефтехимической и коксобензольной промышленности бензол служит хорошим растворителем жиров, смол, каучука, серы и других соединений. В то же время он представляет исходное сырье для получения фенола, стирола, нитробензола, анилина, малеинового ангидрида, моносульфокислоты и других химических продуктов и полупродуктов, используемых для изготовления синтетического каучука, пластмасс, лаков, взрывчатых веществ, фармацевтических препаратов и др.
Возникновение, сырье и разновидности промышленного органического синтеза. Синтезы на основе оксида углерода (II), алканов и алкенов, ацетилена, нафтенов и ароматических углеводородов. Типовые химико-технологические процессы, применяемые в органическом синтезе: гидрирование, дегидрирование, окисление, восстановление, гидратация, гидролиз, алкилирование, сульфирование, хлорирование, нитрование и др. Производство и переработка ацетилена; уксусной кислоты и уксусного ангидрида; производство метанола и этанола; капролактама; стирола; акрилонитрила и метакрилата из пропилена; производство высших жирных спиртов и кислот окислением парафина.
Промышленность органического синтеза каждым годом увеличивает выпуск и ассортимент химических продуктов. Среди них можно указать разнообразные мономеры и на их основе синтетические смолы, каучуки, волокна, пластмассы, клеи, красители и большое количество различных лакокрасочных и смазочных материалов, растворителей, поверхностноактивных веществ, ядохимикатов, флотореагентов, антитфризов и антидетонаторов, взрывчатых и лекарственных препаратов, фотореактивов, душистых соединений и т.п.
1. СЫРЬЕ ПРОМЫШЛЕННОСТИ ОРГАНИЧЕСКОГО СИНТЕЗА
В синтезах сложных органических соединений различают исходные вещества; промежуточные продукты (полупродукты) и готовый продукт.
Исходные вещества - простые углеводороды: метан, этилен. пропилен, бутилен, ацетилен, бензол толуол и др., являются основным сырьем органического синтеза, получаются при химической переработке газообразных, жидких и твердых видов топлива. Раньше основным источником сырья органического синтеза была смола коксования и полукоксования. Широко использовалось сырье растительного и животного происхождения. В последние годы преобладающее значение приобрели жидкие углеводороды нефти, природный и попутные газы, а также газы нефтепереработки.
В настоящее время многие из перечисленных исходных веществ выпускаются десятками и сотнями тысяч тонн.
IIолупродукты : окись этилена, ацетальдегид, фенол, нитробензол и другие - образуются в результате предварительной химической переработки исходных веществ и в свою очередь могут служить сырьем для получения более сложных органических веществ (пластмасс, волокон, красителей, лекарственных препаратов, физиологически активных веществ и д.р.). Связь исходного сырья готовым продуктом можно представить схемой
Например, продукт нефтехимической и коксо-бензольной промышленности бензол служит хорошим растворителем жиров, смол, каучука, серы и других соединений. В то же время он представляет собой исходное сырье для получения нитробензола, анилина, хлорбензола, фенола, этилбензола, изопропилбензола стирола, ДДТ, малеинового ангидрида, фенилэтилового спирта, моносульфокислоты и других химических продуктов и полупродуктов, используемых для изготовления красителей синтетического каучука, пластмасс, лаков, инсектицидов, фармацевтических и дезинфицирующих препаратов, взрывчатых веществ и др.
Рис. 14.1. Использование нефтяного сырья
Из продукта окисления этилена окиси этилена - получают этаноламины, этиленгликодь, ди- и полиэтиленгликоли, уксусный альдегид, диоксан, этиленхлоргидрин, стирол, этиленциангидрин и на их основе - синтетические смолы, каучуки, пластмассы, лаки, волокна, моющие средства, антифриз и другие промышленные продукты.
В настоящее время промышленность органического синтеза пользует следующие основные виды сырья: природные и попутные газы; газообразные и жидкие углеводороды получаемые при перегонке нефти, крекинге и пиролизе нефтепродуктов, твердые парафиновые углеводороды и тяжелые нефтяные остатки; коксовый и сланцевый газы; смолу коксования, а также сланцевую и древесную смолы и торфяной деготь.
Кроме того, в органической технологии в больших количествах используются и неорганические соединения: кислоты, щелочи, сода, хлор и т.п., без которых невозможно осуществление многих процессов. Как правило, любое сырье необходимо предварительно очистить от влаги, механических примесей, сернистых соединений и других примесей и разделить, выделив индивидуальные углеводороды. Так получают очищенное сырье, из которого дальнейшей переработкой можно получить те или иные полупродукты и чистые продукты.
Для выделения газообразных углеводородов применяют методы: сжатие (компрессия) с охлаждением, абсорбционно-десорбционный и адсорбционно-десорбционный. Жидкости чаще всего разделяют перегонкой и ректификацией. Очень часто в промышленности практикуется комбинирование двух или более перечисленных методов. Используя разнообразные методы разделения исходных материалов, а также наиболее современные процессы их переработки, получают важнейшие соединения, являющиеся непосредственным сырьем органического синтеза: синтез-газ (смесь СО и Н 2); насыщенные алифатические углеводороды (от метана до пентанов); индивидуальные моноолефины (от С 2 и выше) и их смеси; диолефины - бутадиен, изопрен и др.) ацетилен; ароматические углеводороды - бензол, толуол, ксилолы и пр.
2. ПРОЦЕССЫ ОРГАНИЧЕСКОГО СИНТЕЗА
Способы переработки любого вида сырья определяются характером продуктов, которые предполагается получить, а также составом и свойствами исходных углеводородов. Для производства продуктов органического синтеза используются типичные реакции органической химии: галогенирование, сульфирование, окисление и восстановление, гидрирование и дегидрирование, гидратация и дегидратация, нитрование, алкилирование, циклизация, изомеризация, конденсация, полимеризация, этерификация и т. п. Промышленность органического синтеза базируется в основном на реакциях синтеза т. е. получение сложных веществ из простых, но в производствах органического синтеза используются и реакции разложения. Деление процессов органического синтеза и название их по видам реакций оправданы тем, что многие из них идут в кинетической области, т. е. общая скорость процесса u определяется скоростью реакции и вычисляется по уравнению
u = d x/d t = k DC (1)
в котором движущая сила процесса DC равна произведению концентраций реагирующих веществ в соответствии с кинетическим уравнением, определяющим порядок реакции, а константа скорости подчиняется уравнению Аррениуса. В процессах органического синтеза, как правило, протекает не одна химическая реакция, а несколько параллельных и последовательных реакций. В результате кроме целевого продукта получаются еще побочные продукты и отходы производства. Соответственно количеству реакций константа скорости процесса может быть сложной функцией констант скоростей нескольких реакций:
k = f (k 1 , k 2 , k 3 , k 4 ….) (2)
причем функциональная зависимость может сильно изменяться с повышением температуры, давления и концентрации реагирующих веществ и других параметров режима. Селективность процесса по целевому продукту определяется соотношением констант скоростей целевой и побочных реакций. Поэтому для интенсификации процессов органического синтеза часто применяют селективные катализаторы, ускоряющие лишь основную реакцию.
Полимеризацию, гидрирование и другие процессы, происходящие с уменьшением объема, часто проводят при повышенных и высоких давлениях для ускорения в повышения равновесного выхода продукта. При повышенном давлении целесообразно проводить процессы абсорбции газов, часто встречающиеся в органическом синтезе. Обратные процессы десорбции, дегидрирования, расщепления молекул с получением газообразных продуктов целесообразно проводить под вакуумом.
В газовых реакциях окисления, хлорирования, гидрирования и других движущую силу DС и скорость процесса u увеличивают варьируя температуру и давление, смещая тем самым равновесие в сторону целевого продукта. При проведении процессов сорбции увеличивают движущую силу процесса повышением концентрации реагирующих веществ или отводом готового продукта из зоны реакции. Применение различных средств интенсификации производственных процессов нередко ограничивается стойкостью органических соединений, что особенно проявляется в высокотемпературных процессах ввиду разложения исходных веществ и продуктов.
Наряду с катализаторами для увеличения константы скорости процесса в производстве органических полупродуктов используют инициаторы, фотосинтез и радиационное облучение. Под действием облучений можно проводить окисление парафиновых углеводородов, хлорирование бензола, полимеризацию этилена, получение привитых полимеров, вулканизацию каучука и т. п. Образовавшиеся продукты обладают более ценными свойствами, чем полученные обычным путем. Так, после облучения сульфохлорированный полиэтилен обладает повышенной теплостойкостью, а также стойкостью к действию кислот, сильных окислителей и в том числе к озону. Большим преимуществом радиационно-химических реакций является существенное сокращение, а в нёкоторых случаях даже отсутствие индукционного периода.
Для ускорения гетерогенных процессов, идущих в диффузионной области, применяют усиленное перемешивание фаз для замены молекулярной диффузии конвективной, что снижает диффузионные сопротивления препятствующие взаимодействию компонентов. Возможность применения тех или иных способов интенсификации определяется их экономической эффективностью, в частности сложностью аппаратурного оформления. Одновременно с внедрением новых технологических схем и процессов непрерывно улучшается и их аппаратурное оформление. Новые, более совершенные аппараты обеспечивают непрерывный процесс по всей технологической цепочке при комплексной переработке сырья. Современные заводы органического синтеза представляют собой соединение различных технологических цехов, не только вырабатывающих определенный (основной) продукт, но и включающих установки тщательно улавливающие и перерабатывающие большинство побочных продуктов, бывших ранее отходами.
Процессы органического синтеза влияют на технологические схемы нефтеперерабатывающих заводов, вызывая глубокое переплетение топливного и химического производства. В связи с тем, что производства органического синтеза многочисленны и разнообразны, ниже рассмотрены примеры типичных производств, имеющих большое народнохозяйственное значение.
3. СИНТЕЗ МЕТИЛОВОГО СПИРТА
Метиловый спирт (метанол ) - важное соединение для получения, главным образом, формальдегида а также - диметилсульфата, диметилтерефталата метилацетата, диметилформамида, аитидетонационных смесей (тетраметилсвинец), ингибиторов, антифризов, метиламина, метилового эфира акриловой кислоты, лаков, красителей и других продуктов. В чистом виде применяется в качестве растворителя и может быть использован как высокооктановая добавка к моторному топливу.
Синтез метилового спирта по физикохимическим условиям его проведения и по технологическому оформлению аналогичен процессу синтеза аммиака. Синтез-газ, как и азотоводородную смесь, можно получать конверсией генераторных газов или природного газа. При синтезе метанола, как и при синтезе аммиака, взаимодействие смеси тщательно очищенных газов происходит при высоких давлении и температуре в присутствии катализаторов. И, наконец, из-за малого выхода конечных продуктов и тот и другой процессы являются циклическими, причем реакцию никогда не вёдут до полного превращения. Поэтому оба синтеза ведут на аналогичных установках, которые монтируют в составе одного завода. Для синтеза берут смесь газов при соотношении СО и Н 2 от 1:4 до 1:8. Процесс ведут при 350 - 400 о С и 2∙10 7 - 3∙10 7 Н/м 2 в присутствии смешанного цинко-хромового катализатора ZnO+Сr 2 О 3 . Основная реакция процесса
СО + 2Н 2 = СН 3 ОН + 111 кДж
Одновременно, особенно при уменьшении давления или увеличении температуры сверх оптимальной могут протекать и следующие побочные реакции
СО + 3Н 2 = СН 4 + Н 2 О + 209 кДж (а)
2СО + 2Н 2 = СН 4 + СО 2 + 252 кДж (б)
2СО = СО 2 + С (в)
СО + Н 2 = СН 2 О + 8,4 кДж (г)
2СН 3 -ОН = СН 3 -О-СН 3 + Н 2 О (д) (диметиловый эфир)
СН 3 -ОН + nСО + 2nН 2 = СН 2 (СН 2) n ОН + nН 2 О (е)
высшие спирты
СН 3 -ОН + Н 2 = СН 4 + Н 2 О (ж)
Количество тех или иных побочных соединений в продукциоиной смеси зависит не только от температуры и давления, но и состава исходной газовой смеси, селективности и состояния катализатора. Наиболее существенной примесью как правило является метан. По сравнению со всеми побочными процессами (а)-(ж) получение метилового спирта идет с максимальным уменьшением объема, поэтому в соответствии с принципом Ле-Шателье повышение давления двигает равновесие в сторону образования метилового спирта. Так как процесс экзотермичен, то при повышении температуры равновесие сдвигается влево и равновесная степень превращения синтез-газа в метиловый спирт уменьшается. В то же время при недостаточно высоких температурах скорость процесса чрезвычайно мала. Поэтому в промышленности процесс ведут в узком интервале температур с колебаниями в 20-30 °С.
Фактические выходы всегда ниже равновесных вследствие недостаточной избирательности применяемых катализаторов. Каталитическую способность для реакции синтеза метанола проявляют многие металлы. В промышленности используется цинк-хромовый катализатор, который получается осаждением оксидов цинка и хрома при соотношении ZnO:Сr 2 О 3 ≈ 2:1. Катализатор восстанавливают в токе того же газа. Длительность работы такого катализатора без регенерации колеблется от 4 до 6 месяцев. Общая скорость реакции синтеза определяется адсорбцией водорода.
Температурная зависимость константы скорости прямой реакции описывается уравнением Аррениуса и соответствует энергии активации Е = 100 кДж/моль.
Интервал оптимальных температур соответствующих наибольшему выходу продукта определяется активностью катализатора, объемной скоростью газовой смеси и давлением. Для цинк-хромового катализатора при давлениях около 5∙10 6 -25∙10 6 Н/м 2 и объемных скоростях 20 000-40 000 ч -1 оптимальные температуры колеблются в пределах 360-380 0 С. На низкотемпературных катализаторах, например на медь-цинк-алкалюминиевых катализаторах, используемых при 220-280 °С, процесс осуществляется при более низких давлениях 4∙10 6 -10∙10 6 Н/м 2 .
В производстве процесс синтеза осуществляется при объемных скоростях 20 000- 40 000 ч -1 и выход метанола составляет около 4% за один проход. При увеличении объемной скорости до 100 000 ч -1 степень превращения исходной смеси за один проход уменьшается, но при циклической схеме с рециркуляцией газов количество полученного метилового спирта возрастает, так как степень превращения снижается медленнее, чем увеличивается объемная скорость .
Технологическая схема производства метилового спирта представлена на рис 14.2. Исходная смесь газов после предварительной очистки от примесей сжимается пятиступенчатым компрессором до 25×10 6 Н/м 2 . После каждой ступени сжатия установлены холодильник (не показанные на схеме), которые отбирают тепло сжатия. Затем газовая смесь смешивается в смесителе с циркуляциовным газом и, пройдя фильтр для очистки от масла, поступает в трубное пространство теплообменника, где нагревается примерно до 220 °С за счет тепла реакционных газов и далее направляется в колонну синтеза (высота 12-18 м, внутренний диаметр 0,8-1,2 м, толщина стенок 0,09-0,1 м).
Рис. 14.2. Схема установки для синтеза метилового спирта из оксида углерода и водорода: 1 - компрессор; 2 - смеситель; 3 - фильтр; 4 - трубчатий теплообменник; 5 - циркуляционный компрессор; 6 колонна синтеза; 7 - холодильник-конденсатор; 8 – сепаратор; 9 - сборник спирта-сырца.